

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Thermochemistry of Substitution Reactions
المؤلف:
John D. Roberts and Marjorie C. Caserio
المصدر:
Basic Principles of Organic Chemistry : LibreTexts project
الجزء والصفحة:
........
3-1-2022
2018
Thermochemistry of Substitution Reactions
Ionic or polar reactions of alkyl halides rarely are observed in the vapor phase because the energy required to dissociate a carbon-halogen bond heterolytically is almost prohibitively high. For example, while the heat of dissociation of chloromethane to a methyl radical and a chlorine atom is 84kcal mol−1 (Table 4-6), dissociation to a methyl cation and a chloride ion requires about 227kcal mol−1:
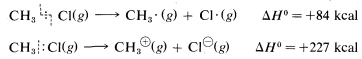
However, the heat of ionic dissociation of methyl chloride in aqueous solution is estimated to be 63kcal, and while this reaction is still substantially endothermic, it requires about 227−63=164kcal less energy than in the gas phase:
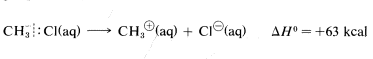
The reason is that ions are much more stable in water than in the gas phase; for example, the transfer of a chloride ion from the gas to water is exothermic by −85kcal−1. The ΔH0 value for the corresponding transfer of a methyl cation, CH3⊕, is not known with certainty, but is about −80kcal. These ionic solvation energies are clearly large. In contrast, the ΔH0 for solution of methyl chloride in water is small (about 1kcal). We can use these data to calculate the heat of ionic dissociation of chloromethane in water:
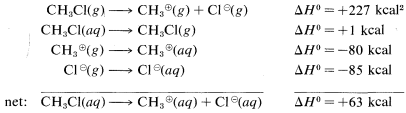
Thermochemical data for the solvation of ions as used in the preceding calculations are difficult to measure and even to estimate. Therefore this kind of calculation of ΔH0 for ionic reactions involving organic molecules in solution usually cannot be made. As a result, we have considerably fewer possibilities to assess the thermodynamic feasibility of the individual steps of polar reactions in solution than we do of vapor-phase radical processes. Bond energies are not of much use in predicting or explaining reactivity in ionic reactions unless we have some information that can be used to translate gas-phase ΔH0 values to solution ΔH0 values.
Calculated from the following data:
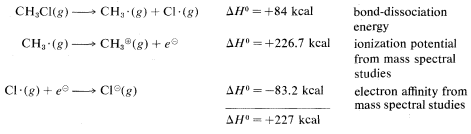
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















